15 rokov liečby biosimilárnymi liekmi
Pridané: 18. 05. 2021
PRINT, dátum: 18.5.2021, zdroj: Lekárnické listy
Proces hodnotenia biosimilárnych liekov v rámci EÚ prináleží Európskej liekovej agentúre (EMA). Rozhodnutie o uvedení lieku na trh v EÚ vydáva Európska Komisia, jej schválenie platí pre všetky členské štáty v EÚ dňom vydania rozhodnutia.
EÚ je priekopníkom v oblasti biosimilárnych regulácií. Vďaka vedeckým poznatkom, odhodlaniu, vízie a nadšeniu odborníkov sa stal 12. apríl 2006 míľnikom v sprístupnení prelomovej biosimilárnej liečby v Európe. Cesta hodnotenia registračnej dokumentácie prvého biologicky podobného lieku regulačným úradom EMA predstavovala jeden z kľúčových krokov pre odštartovanie éry sprístupnenia terapie biologicky podobnými liekmi širokej verejnosti a obyvateľom členských štátov EÚ. Dovtedy neexistovali skúsenosti s vedeckými a právnymi požiadavkami na takúto registráciu. „Posúdenie prvej aplikácie biologicky podobného lieku trvalo asi jeden a pol roka. Táto prvá aplikácia spustila vytvorenie nového právneho a regulačného rámca pre biologicky podobné lieky v Európe.“1
Všetky biologicky podobné lieky dostupné v Európe sú vyvíjané, vyrábané a schvaľované podľa prísnej legislatívy EÚ navrhnutej tak, aby stanovovala najvyššie štandardy bezpečnosti, účinnosti a kvality. Na biologicky podobné lieky sa vzťahujú rovnako prísne požiadavky na farmakovigilanciu, ako na všetky ostatné biologické lieky v EÚ.
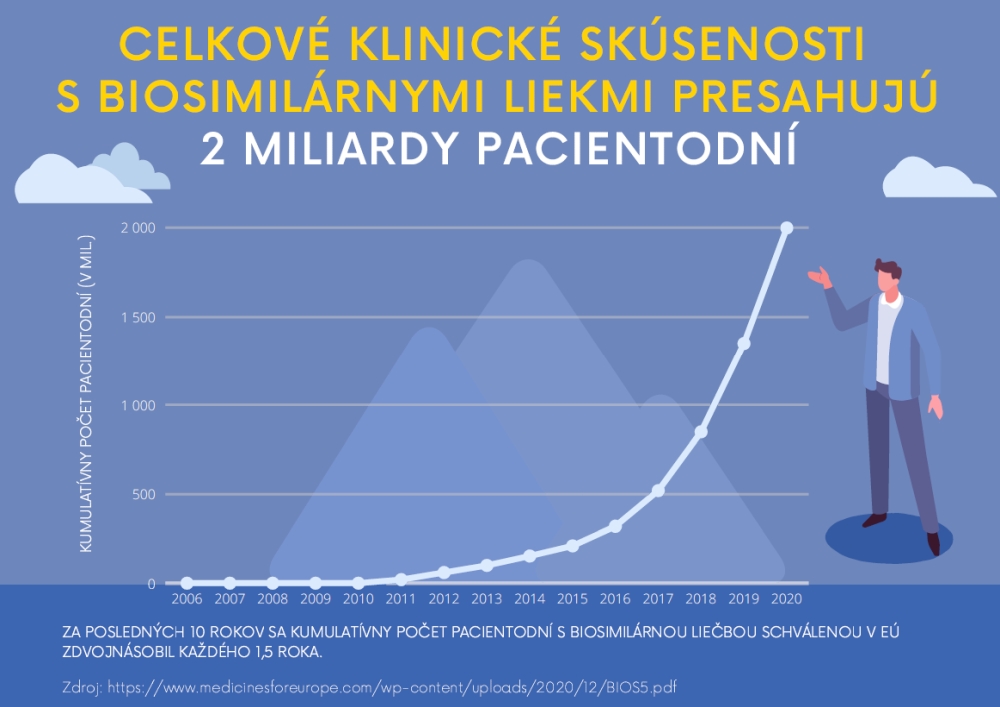
Od prvého schválenia biologicky podobného lieku v roku 2006 sa úspešne dosiahlo už viac ako 2 miliardy pacientodní2 len v Európe, čo svedčí o bezpečnosti a účinnosti, ako aj o sil nom regulačnom rámci pre biosimilárne lieky. Na základe prieskumu Medicines for Europe3 v roku 2020 je v EÚ dostupných množstvo nových biologicky podobných liekov obsahujúcich liečivá, akými sú: Adalimumab, Bevacizumab, Enoxaparin Sodium, Epoetin, Etanercept, Filgrastim, Follitropin Alfa, Infliximab, Insulin glargine, Insulin Lispro, Pegfilgrastim, Rituximab, Somatropin, Teriparatide, Trastuzumab. Avšak, na Slovensku nie sú všetky registrované biosimilárne lieky v EÚ dostupné pre pacientov. Na druhej strane, Slovensko patrí ku krajinám, v ktorých pozitívne skúsenosti s liečbou biologicky podobnými liekmi obsahujúcimi liečivo, ako napr. erytropoetín, filgrastim, sa lieči výhradne biosimilármi. Biologické referenčné lieky (originálne lieky) sa v daných prípadoch už na Slovensku nepoužívajú. Onkologickí pacienti sú takto liečení už 12 rokov.
Biologický liek predstavuje nový terapeutický prístup, zameraný na zistenie príčiny ochorenia a zabezpečuje cielenú liečbu. Biosimilárne lieky sú vyrábané biotechnológiou a uvádzajú sa na trh až po vypršaní patentovej ochrany biologického referenčného lieku. Sú vyvinuté tak, aby boli veľmi podobné existujúcemu biologickému referenčnému lieku, malé rozdiely sa vyskytujú pri všetkých biologických liekoch, nakoľko ich účinné látky sú veľké, komplexné molekuly, pochádzajúce zo živých buniek.

Tieto malé rozdiely sú akceptované len v prípade, že nie sú klinicky relevantné. Takéto malé rozdiely sa môžu vyskytovať aj v jednotlivých šaržiach toho istého výrobcu biologického referenčného lieku. Biologická liečba sa používa v onko-hematológii, gastroenterológii, reumatológii, onkológii, dermatológii. Najviac skúseností s modernými biosimilárnymi liekmi majú na Slovensku pacienti so zápalovými ochoreniami tráviaceho traktu, reumatickou artritídou a onkohematologickí pacienti. Onkohematologickí pacienti na Slovensku sú liečení biosimilárnymi liekmi už od roku 2009. Používanie biologicky podobných monoklonálnych protilátok (napr. infliximab) sa u nás traduje od roku 2013.
Tak, ako pri každom inom lieku, aj pri biologicky podobnom lieku je pred jeho schválením pre uvedenie na trh potrebné preukázať, že jeho prínosy prevažujú riziká. Vyžaduje si to veľké množstvo dokumentácie, vrátane údajov týkajúcich sa čistoty a výroby, ako aj správneho fungovania biologicky podobného lieku a tiež rozsiahle porovnanie s referenčným biologickým liekom. Porovnania sa vykonávajú postupným spôsobom, ktorý sa začína podrobnými fyzicko-chemikálnymi štúdiami v laboratóriu, pri ktorých sa porovnáva štruktúra s funkciou liekov, a následne sa podľa potreby prechádza na porovnávacie klinické štúdie (štúdie na ľuďoch).
Vzhľadom na spôsob, akým sa biologicky podobné lieky vyvíjajú, nie je vždy potrebné uskutočňovať klinické štúdie o biologicky podobnom lieku pri všetkých ochoreniach, pri ktorých sa preukázala účinnosť referenčného biologického lieku. Namiesto toho je niekedy možné rozšíriť údaje o bezpečnosti a účinnosti zo štúdií jedného ochorenia na ostatné chorobné stavy. Tento postup je známy ako extrapolácia. Rozhodnutie o tom, či sa na liečbu ďalších stavov budú vyžadovať nové klinické štúdie, prijíma Európska agentúra pre lieky (EMA) podľa jednotlivých prípadov, pričom vychádza z vedeckých dôkazov.
Hodnota biologicky podobných liekov pre pacientov a systém zdravotnej starostlivosti je dobre známa. Poskytujú nielen rýchlejší prístup k liečbe, ale tiež zlepšujú zdravotné výsledky vhodným, práve skorším používaním biologickej liečby. Mnohé analýzy dokazujú, že za rovnaké finančné prostriedky vynaložené na biologickú liečbu, biosimilárnymi liekmi je možné odliečiť oveľa väčší počet pacientov. Až 70 % – 80 % všetkých nákladov na zdravotnú starostlivosť v EÚ – odhadovaných 700 miliárd eur – sa v súčasnosti vynakladá na liečbu chronických ochorení4.
Biosimilárne lieky významne prispievajú k udržateľnosti zdravotnej starostlivosti v Európe, navyše pomáhajú riešiť jednu z hlavných výziev – ako zabezpečiť, aby všetci európski pacienti mali spravodlivý prístup k požadovanej liečbe. Biosimilárne lieky prispievajú k zníženiu čakacích dôb na liečbu a to najmä v onkológii, onko-hematológii, liečbe autoimunitných ochorení, ako aj liečby cukrovky. Podľa skúsenosti z Bavorska, zavedenie a používanie biosimilárnej liečby vo forme infliximabu, etanerceptu a adalimumabu sa prejavilo výrazným skrátením dĺžky liečby syntetickými liekmi pre reumatických pacientov zo 7,4 roka na 4 mesiace5.
Na Slovensku sme podľa analýzy INEKO (2018) „zaostávaním v príchode biosimilárov strácali ročne 28 – 40 miliónov eur z verejných zdrojov. Vďaka vstupu 22 biosimilárnych liekov na trh v rokoch 2018 – 2020 sa už prevažná väčšina tejto úspory využíva. Prispelo k tomu uplynutie patentovej ochrany referenčných liekov, ako aj otvorenejší prístup Všeobecnej zdravotnej poisťovne (VšZP) pri centrálnych nákupoch biologických liekov, osobitne pri molekulách infliximab, rituximab, trastuzumab a etanercept. Konkurenčný tlak biosimilárnych liekov znižuje ceny liekov s rovnakou účinnou látkou. Vďaka tomu môže byť podľa orientačného odhadu INEKO v rokoch 2020 až 2021 realizovaná úspora vo verejných zdrojoch vo výške 28 – 34 miliónov eur ročne. Tieto peniaze bude možné ušetriť bez negatívneho vplyvu na pacientov alebo použiť na zvýšenie dostupnosti liečby pre viacerých pacientov, či na iné priority v zdravotníctve.“6
MUDr. Terézia Szádocka, MPH.
PharmDr. Michaela Palágyi, PhD.
GENAS Asociácia pre generické a biosimilárne lieky
Zdroje:
1. www.linkedin.com/pulse/beginning-biosimilar-medicines-journey-how-vision-marechal-jamil/?trackingId=Z2Lulz1ISTjwTxMaiB0spg%3D%3D
2. www.medicinesforeurope.com/wp-content/uploads/2020/12/BIOS5.pdf
3. Biosimilars-Market Review-2020.cdr (medicinesforeurope.com) www.medicinesforeurope.com
4. www.medicinesforeurope.com/wp-content/uploads/2020/12/BIOS1.pdf
5. INEKO: Analýza stavu a možností širšieho využívania generických a biosimilárnych liekov na Slovensku 2020, (www.ineko.sk/clanky/publikacie)