Biosimilárne lieky zabezpečujú dostupnosť modernej biologickej liečby výrazne vyššiemu počtu pacientov
Pridané: 04. 10. 2021
Pred 15 rokmi, v roku 2006, Európska lieková agentúra (EMA) schválila prvý biologicky podobný (biosimilárny) liek v EÚ. Od tej doby bolo v EÚ schválených ďalších približne 70 biosimilárnych liekov, ktoré podľa Medicines for Europre priniesli pacientom viac ako 2 miliardy liečebných dní. Navyše, kumulatívne dni liečenia pacientov za ostatných 10 rokov sa každých 1,5 roka zdvojnásobili. Biosimilárne lieky sú aj na Slovensku stále viac dostupné. Práve z toho dôvodu sa GENAS - Asociácia pre generické a biosimilárne lieky rozhodla vyhlásiť prvý októbrový týždeň za Týždeň povedomia o biosimilárnych liekoch.
Dramatický nárast používania biosimilárnych liekov
Z dôkazov získaných počas 15 rokov klinických skúseností vyplýva, že biologicky podobné lieky povolené Európskou liekovou agentúrou sa môžu používať pri schválených indikáciách rovnako bezpečne a účinne ako ostatné biologické lieky.
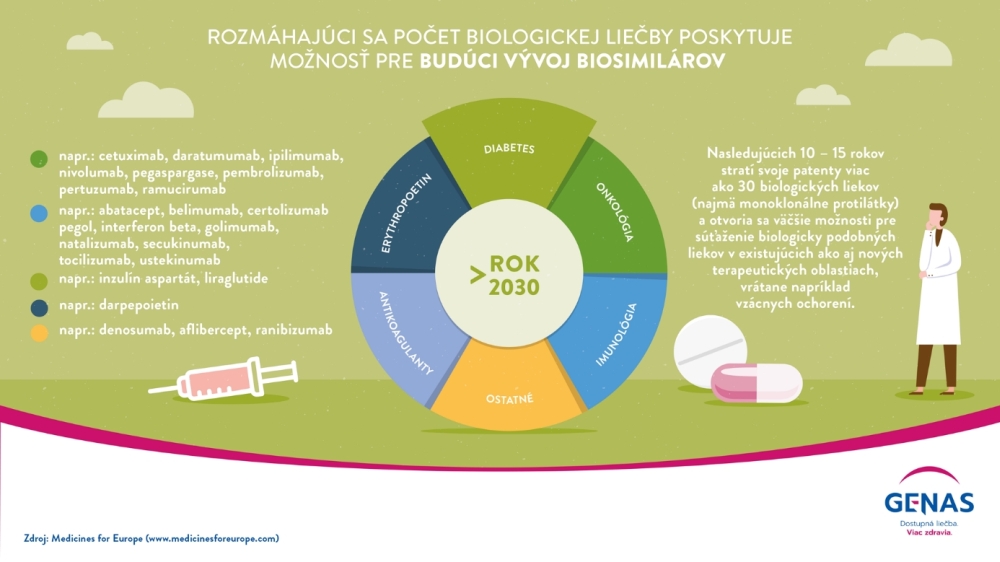
Biosimilárne lieky predstavujú podľa dát IQVIA 9 % európskeho trhu s biologickými liekmi (za rok 2020). Avšak nárast ich používania v EÚ je dramatický. Zatiaľ čo medziročný nárast referenčných biologických liekov (tzv. originálov) za posledných 5 rokov bol 2 %, u biosimilárnych liekov je to až 58 %. V najbližších 10 - 15 rokoch stratí patenty ďalších 30 molekúl referenčných biologických liekov, ktoré otvoria dvere vývoju ich biosimilárnych alternatív v doterajších, ale aj nových terapeutických oblastiach, vrátane vzácnych ochorení. „Z lepšej dostupnosti biosimilárnej alternatívy nákladnej biologickej liečby bude profitovať stále viac pacientov, pre ktorých je dostupnosť biologickej liečby obmedzená, pretože prostriedky zdravotného systému sú limitované a náklady na tieto lieky stále rastú“, konštatuje MUDr. Terézia Szádocka, MPH, prezidentka asociácie GENAS.
Doterajšie skúsenosti ukazujú, že biosimilárne lieky významne zlepšujú prístup pacienta k vysoko kvalitným liečebným postupom. Nielenže môže byť oveľa viac pacientov liečených biologickou liečbou, ale skracuje sa aj čakacia doba na liečbu. „Práve z týchto dôvodov sme sa rozhodli iniciovať osvetový Týždeň povedomia o biosimilárnych liekoch, ktorý by mal prispieť k lepšej informovanosti, porozumeniu a používaniu tejto liečby, čo významne prispieva k udržateľnosti systému zdravotnej starostlivosti“, dodáva Szádocka.
Príležitosť pre najbližšie obdobie
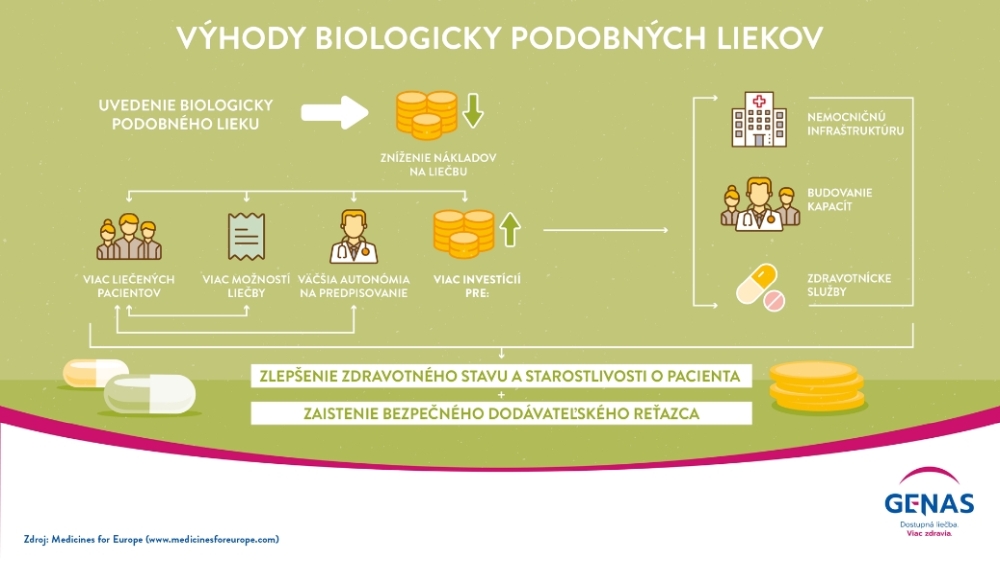
Vďaka 15 - ročným pozitívnym klinickým skúsenostiam s biosimilárnou liečbou predstavujú biologicky podobné lieky obrovskú príležitosť poskytnúť výrazne lepší prístup k moderným terapiám miliónom európskych pacientov v chronickej aj akútnej starostlivosti, pri chorobách ako je rakovina, cukrovka, reumatoidná artritída, zápalové ochorenia čriev, alebo pri iných ochoreniach súvisiacich s poruchou imunity organizmu. Po vypršaní patentovej ochrany referenčného biologického lieku sa biosimilárne lieky stávajú ich konkurenciou, ktorá významne tlačí na pokles cien týchto liekov. Vstupom nových biosimilárnych liekov na trh sa vytvára konkurenčné prostredie, ktoré môže vygenerovať značné úspory verejných zdrojov na lieky.
Podľa IQVIA analýz sa odhaduje, že takmer 50 % budúcich príležitostí s cieľom úspor na lieky v Európe bude pochádzať práve z používania biologicky podobných liekov (biosimilar). Preto je stále potrebné nezaujaté vzdelávanie nielen odbornej verejnosti (lekárov) ale aj pacientov. Avšak nemenej dôležité je aj aktualizácia pokynov pre predpisujúcich lekárov na základe spoľahlivých medicínskych dôkazov zo strany zákonodarcov.
Vyspelé krajiny vedú vo využívaní biosimilárov
Najvyššiu penetráciu biosimilárnych liekov v rámci EÚ registrujeme v škandinávskych krajinách, kde je priemerný podiel biosimilárov v niektorých terapeutických skupinách okolo 90 %.
V Dánsku sa miera používania biosimilárov niektorých biologických liečiv, ktoré liečia imunologické ochorenia, pohybovala od 85 % do 97 % podielu na trhu do jedného roka od ich vstupu na trh.
V Nemecku dnes biologicky podobné lieky predstavujú 27 % až 89 % podiel na trhu, ktorý sa líši v závislosti od regiónu a typu molekuly. V Bavorsku, súťaž biosimilárnych liekov viedla k rýchlejšiemu prístupu k biologickej liečbe u pacientov s reumatickými ochoreniami. Používanie biosimilárneho infliximabu, etanerceptu a adalimumabu sa prejavilo výrazným skrátením trvania terapie syntetickými liekmi pre pacientov s reumatickými ochoreniami zo 7,4 rokov na 4 mesiace. Podobný trend pozorujeme napríklad aj v Poľsku, kde sa napríklad pri infliximabe a trastuzumabe penetrácia biosimilárov blíži k 100 %.
Z týchto dôvodov by sa mal vo verejnom záujme podporovať čo najrýchlejší vstup biosimilárnych liekov na trh a ich intenzívnejšie používanie v lekárskej praxi v prospech pacientov.
Biosimiláry zlepšujú dostupnosť drahých onkologických liekov
Biosimilárne lieky zvyšujú dostupnosť drahej biologickej liečby pre onkologických pacientov. Odhaduje sa, že len 3 molekuly používané na liečbu onkologických pacientov v roku 2020 tvorili 15 % všetkých nákladov na lieky pre onkologické ochorenia, a že biologicky podobné alternatívy by mohli priniesť zníženie nákladov na túto liečbu o 2,4 miliardy EUR v Európe ročne. „Existujúca súťaž biologicky podobných liekov na onkologické ochorenia vytvorila úspory, ktoré sú príležitosťou na reinvestovanie do iných inovácií a služieb v zdravotníctve. Lieková politika u nás by mala podporovať používanie biologicky podobných liekov“, dodáva Szádocka.
Premrhané príležitosti?
Napriek tomu, že výhody, ktoré biologicky podobné lieky jednoznačne prinášajú, existuje ešte nevyužitý potenciál, ktorý by mohol prispieť k efektívnejšiemu využívaniu zdrojov v oblasti zdravotnej starostlivosti, tak pre krajinu, ako aj pre pacientov. Ak by európske krajiny dosiahli v roku 2020 cieľovú úroveň využitia biologicky podobných liekov v rámci spotrebiteľského reťazca na úrovni 80%, bolo by k dispozícii najmenej 340 miliónov EUR na reinvestície do systémov zdravotnej starostlivosti. Najefektívnejšie využitie potenciálu biosimilárnych liekov je v tých krajinách, kde systém ich obstarávania je jasne definovaný platcom, vrátane garantovaného objemu, ako aj mechanizmov na podporu predpisovania liekov. Modely zdieľania výhod, kde sa časť úspor spojených s používaním biologicky podobných liekov rozdeľuje a reinvestuje v prospech rôznych zúčastnených strán (napr. pacientov, lekárov a platcov), sa ukázali ako jedna z najúspešnejších politík na zvýšenie používanie biologicky podobných liekov tak v nemocničnom, ako aj v ambulantnom sektore.
Kým pozícia biosimilárov na európskom thu z roka na rok vykazuje výraznejší nárast, v roku 2020 v počte balení to činilo 10% a v objeme 8% z celkového trhu biologických liekov, na Slovensku za rovnaké obdobie sa zaznamenalo iba 5% balení a 3% z celkového vynaloženého objemu na biologickú liečbu.
Čo je biologicky podobný liek?
Všetky biologicky podobné lieky dostupné v Európe sú vyvíjané, vyrábané a schvaľované podľa prísnej legislatívy EÚ, ktorá dáva záruku dodržania všetkých štandardov bezpečnosti, účinnosti a kvality u všetkých liekov. Na biologicky podobné lieky sa v EÚ vzťahujú rovnako prísne požiadavky na farmakovigilanciu, ako na referenčné biologické lieky.
Proces hodnotenia biosimilárnych liekov v rámci EÚ prináleží Európskej liekovej agentúre (EMA).
Rozhodnutie o uvedení lieku na trh v EÚ vydáva Európska Komisia, jej schválenie platí pre všetky členské štáty v EÚ dňom vydania rozhodnutia.
Biosimilárne lieky sú vyrábané biotechnológiou a uvádzajú sa na trh až po vypršaní patentovej ochrany biologického referenčného lieku. Sú vyvinuté tak, aby boli veľmi podobné existujúcemu biologickému referenčnému lieku, malé rozdiely sa vyskytujú pri všetkých biologických liekoch, nakoľko ich účinné látky sú veľké, komplexné molekuly, pochádzajúce zo živých buniek. Tieto malé rozdiely sú akceptované len v prípade, že nie sú klinicky relevantné. Schválený biologicky podobný liek sa používa v rovnakej dávke na liečbu rovnakých ochorení, ako referenčný liek. Ak sa na používanie referenčného lieku vzťahujú osobitné bezpečnostné opatrenia, tie isté opatrenia budú zvyčajne platiť aj pre používanie biologicky podobného lieku.
Zoznam všetkých biologicky podobných liekov, ktoré sú v EÚ centrálne schválené, sa nachádza na webovej stránke agentúry EMA. Informáciu o tom, či je liek biologicky podobným liekom, možno nájsť v súhrne charakteristických vlastností lieku (SPC).
Ako sa hodnotia biologicky podobné lieky v EÚ?
Keďže referenčný liek je v EÚ registrovaný už niekoľko rokov a jeho klinický prínos je stanovený, niektoré štúdie uskutočnené s referenčným liekom nie je potrebné opakovať. Okrem údajov týkajúcich sa čistoty a výroby, ako aj správneho fungovania biologicky podobného lieku sa tiež vyžaduje rozsiahle porovnanie s referenčným biologickým liekom. Porovnania sa vykonávajú postupným spôsobom, ktorý sa začína podrobnými fyzikálno - chemickými skúšaniami v laboratóriu, a následne sa podľa potreby prechádza na porovnávacie klinické štúdie (štúdie na ľuďoch).
Vzhľadom na spôsob, akým sa biologicky podobné lieky vyvíjajú, nie je vždy potrebné uskutočňovať klinické štúdie o biologicky podobnom lieku pri všetkých ochoreniach, pri ktorých sa preukázala účinnosť referenčného biologického lieku. Namiesto toho je niekedy možné rozšíriť údaje o bezpečnosti a účinnosti zo štúdií jedného ochorenia na ostatné chorobné stavy. Tento postup je známy ako extrapolácia. Rozhodnutie o tom, či sa na liečbu ďalších stavov budú vyžadovať nové klinické štúdie, prijíma Európska agentúra pre lieky (EMA) podľa jednotlivých prípadov, pričom vychádza z vedeckých dôkazov.Biologicky podobné lieky sa vyrábajú podľa rovnakých noriem ako iné biologické lieky a regulačné úrady vykonávajú pravidelné kontroly výrobných miest.
Ako sa sleduje bezpečnosť biologicky podobných liekov?
Tak ako pri všetkých liekoch sa bezpečnosť biologicky podobných liekov po povolení nepretržite sleduje. Každá spoločnosť musí vytvoriť systém na sledovanie vedľajších účinkov hlásených pri používaní svojich liekov. Pacienti môžu taktiež sami oznámiť podozrivé vedľajšie účinky. Ak sa vyskytnú takéto hlásenia u akéhokoľvek lieku či už referenčného biologického resp. biosimilárneho, regulačné úrady ich vyšetria a prijmú náležité opatrenia. Na biologicky podobné lieky sa vzťahujú rovnako prísne požiadavky na farmakovigilanciu, ako na všetky ostatné biologické lieky v EÚ.
1. Zdroj: IQVIA – Rx Sell In databáze, 2020
2. Zdroj: IQVIA – Rx Sell In databáze, 2019
3. Zdroj: INEKO: Analýza stavu a možností širšieho využívania generických a biosimilárnych liekov na Slovensku 2020, (http://www.ineko.sk/clanky/publikacie).